안녕하세요. 지난 3월 27일에 있었던 주주총회에 참석하지 못하신 주주분들을 위해, 당시 언급되었던 내용을 아래와 같이 정리하였습니다.
최근 각 가정과 회사에서 COVID19로 모든 분들이 고생 많으실 텐데 건강 유의하시기 바랍니다.
NDA 제출에 관한 사항
SVHD(단심실)환자에게 있어 가장 적절한 운동능력 측정지표가 Max VO2가 아닌 VO2 VAT라는 사실을 FUEL 임상결과로 확인한 바 있습니다. 이 결과에 대해서 회사는 작년 10월 Type C 미팅을 하였고 FDA는 이 새로운 결과를 뒷받침할 수 있는 추가자료가 있는지 물어보았습니다. 그래서 회사는 추가자료를 확보하여 향후 NDA를 문제없이 제출하기 위해 지난 몇 개월간 노력했습니다.
1) FUEL OLE 장기안전성 시험 interim 결과 자료
NDA에 추가될 자료 중 첫번째로 장기 안전성 시험인 FUEL OLE interim report입니다. 원래 FUEL OLE임상은 유데나필의 효력을 보기 위한 임상시험이라기 보다는 말 그대로 약물의 장기 복용에 대한 안전성을 평가하기 위한 임상입니다. 하지만 이 임상시험도 2차 지표로 FUEL 임상처럼 Max VO2와 VO2 VAT을 측정하게 디자인되어 있고 따라서 OLE자료를 활용하면 FUEL임상 결과를 다시 한번 확증할 수 있는 좋은 자료가 될 것이라고 판단하였습니다.
OLE 임상시험은 FUEL 임상시험을 완료한 환자 (400명) 중 장기 안전성 시험을 원하는 300명을 대상으로 진행하고 있습니다. 작년 7월에 마지막 환자까지 모집을 완료하였습니다.
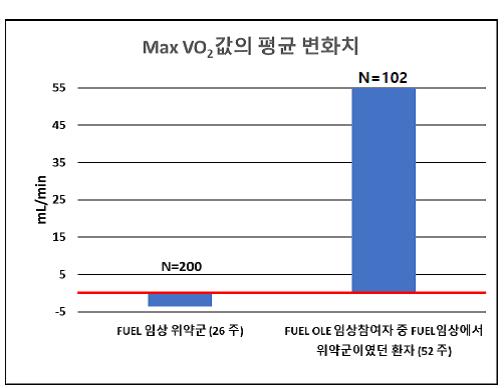
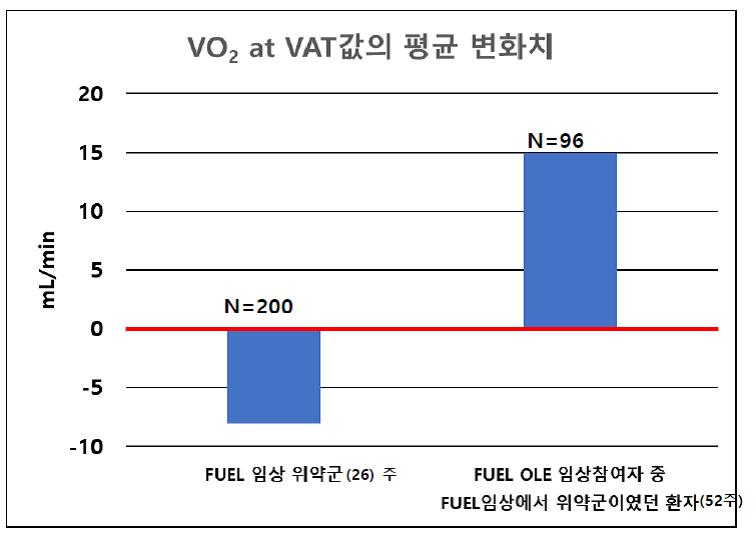
OLE 임상시험에서는 52주에 이 수치를 확인하게 디자인 되어있는데, 이번에 포함될 자료는 2019년 12월 말까지 52주 투여를 완료한 환자 222명 중 결과가 확인된 198명의 자료가 사용되었습니다. FUEL 임상의 결과와 직접적으로 비교가 가능한 OLE 참여환자 즉, FUEL 임상시험에서 위약을 투여 받은 환자가 roll-over한 케이스를 확인(N=109)하여 Max VO2와 VO2 VAT의 변화 값을 측정하였습니다.
결과는 FUEL 임상시험과 마찬가지로 두개의 지표에서 약에 의한 운동능력치가 상승한 것을 확인할 수 있었습니다. (그림 1, 2) OLE의 경우는 본래 효력을 확인하는 것이 주 목적이 아니기에 통계학적 분석을 하지는 않지만 약의 효력을 재확인하기에는 충분한 데이터라고 할 수 있고 FUEL 결과를 증빙하는 참고자료로서 FDA에서도 사용을 인정한 내용입니다. 다시 말하자면, 이중맹검이 아니고 p값이 존재하는 것은 아니지만 수치의 증감과 트랜드를 확인하기엔 충분한 자료인 것입니다. 그리고 통계적으로 의미 있는 증가에 대해서는 이미 임상3상 자료를 통해 입증이 되었습니다.
<그림 1>
<그림 2>
2) VO2 VAT 지표 타당성에 대한 신규 논문
두 번째 추가자료로서는 PHN소속 의사들이 VO2 VAT 지표가 SVHD환자에게 더 적절한 지표라는 내용을 다룬 논문입니다.*골드버그 박사님을 비롯하여 기타 PHN소속 의사들의 집단 연구 논문이고 FDA에서 현재 요청하고 있는 추가자료에 충분히 활용될 수 있는 논문입니다. 본 논문은 abstract는 2018년에 제출되었고, 올 상반기에 최종본이 학술지에 게재될 예정입니다.
논문의 개요는 폰탄수술을 받은 336여명의 환자를 10년이상 모니터링하여 운동능력수치의 변화를 확인한 연구인데, 결과적으로 나이가 들어감에 따라 정상인 대비 Max VO2 측정치는 크게 하락하는데 비하여 VO2 VAT 측정치 경우는 그 하락폭이 크지 않았습니다. 이는 VO2 VAT 측정치를 임상지표로 사용하는 것이 약효과를 확인하는데 있어서 더욱 정확한 지표라는 것을 증명하고 있다는 내용입니다.
Max VO2측정치가 하락하면 할수록 증가 변화폭이 좁아지게 되고, 그렇게 되면 약물을 써서 그 수치를 향상시킬 수 있는 폭 자체가 좁아지게 됩니다. 따라서 약효력을 확인하기에 적절한 지표로 사용하기엔 무리가 있다는 의미입니다.
반면 VO2 VAT의 값은 나이가 들어도 그 수치가 잘 보존되기 때문에 약물치료의 효과를 더 정확하게 확인하고 측정할 수 있다는 말입니다. 현재 FUEL임상 결과의 타당성을 입증했고 FDA 입장에서 볼 때 신약 심사의 판단을 더욱 논리적이고 의학적으로 하는데 이 논문만큼 중요한 자료는 없다고 봅니다.
* Abstract 14220: Longitudinal Change in Exercise Capacity and Predictors of Performance After Fontan: Results From the Pediatric Heart Network Fontan 3 Study, David J. Goldberg, Victor Zak, Brian W. McCrindle, Hua Ni, Jonathan Rhodes, Robert P. Garofano, Jonathan R. Kaltman, Linda M. Lambert, Lynn Mahony, Renee Margossian, Zebulon Z. Spector, Richard V Williams, Andrew M Atz and Stephan Paridon. Circulation, Volume 138, Issue Suppl 1., 2018.
따라서 NDA를 제출하는데 있어서 FDA가 승인을 위해 요청한 핵심자료 두가지 (OLE interim 결과자료와 PHN 논문자료)를 구비하고 갖추기 위한 그 동안 추가 시간이 소요되었습니다. 결과적으로 NDA 신청시기는 5월말로 예상하고 있고 승인에 대한 확률은 그만큼 더 올라갔다고 회사는 판단하고 있습니다.
약가와 환자 수에 대한 사항
1) 약가
미국시장에서 의료보험사와 보험적용범위를 결정하는 제일 중요한 요인은 임상결과입니다, 승인된 약이 없는 아동희귀병인 SVHD는 지난 몇 년간 여러차례 인터뷰를 통해 14~5개의 보험사로부터 유데나필의 FDA 승인 시 모든 보험사로부터 보험적용을 해주겠다는 긍정적인 반응을 확인하였습니다. 가격을 포함해 적용범위를 결정할 때 3상에서 증명된 운동능력향상결과와 현재 진행 중인 FALD 임상시험에서 나올 간기능 저하 억제결과를 추가로 사용할 계획입니다.
단일약이 환자들에게 절실하게 필요로 하는 운동능력 향상 및 간기능 저하 억제효과를 동시에 얻을 수 있다는 건 아주 드문 일이기에 좋은 결과가 나올 거라 기대합니다. 참고로 희귀병 치료제의 가격은 환자 숫자와 효능에 따라 적게는 연간 5만불에서 많게는 160만불까지 다양하게 책정되어 있습니다. 현재 회사에서 예상하고 있는 약가책정이 향후 시장에 반영될 것으로 예상하고 있습니다.
2) 환자수
미국내에 정확한 환자숫자의 파악을 위해 HVH라는 회사에 컨설팅을 받았습니다. 이 회사는 질병 및 관련 건강 문제의 국제 통계분류를 나타내는 ICD 9/10 CODE를 사용하여 지난 5년간 SVHD로 보험적용을 받은 모든 환자들을 특별 알고리즘을 사용해 파악했으며 메지온은 약 78,000명의 환자들 신상정보를 받아 소유하고 있습니다. 보험 코드 조회를 통해 Fontan과 관련된 치료비가 청구된 것을 추출근거로 얻은 이 자료는 다른 어떤 방법으로 나온 데이터보다 정교하다고 생각합니다.
78,000명중 12세에서 19세 환자는 대략 19,000명, 19세 이상의 환자는 대략 5,000명정도로 보고 있고 12세 미만 환자수는 50,000명 이상으로 파악하고 있습니다. 이는 SVHD 환자들이 나이가 증가함에 따라 심장기능이 약해지고 또한 간경화가 진행되어 일찍 사망하는 통계학적 수치를 반영하고 있습니다. 따라서 SVHD환자들을 위한 삶의 질과 수명 연장이 이루어진다면 그만큼 시장도 커져가는 구조인 것입니다
EAP에 대한 설명
사실 상 적지 않은 비용을 감수하면서 EAP를 실시하려고 했던 본래 목적은 신약 launching전에 최대한 환자를 확보하는 것 이였습니다.
좋은 임상자료가 나온 현 시점에서는 EAP를 무리하게 강행할 필요가 없다는 것이 회사 입장입니다. 그리고 이 외에도 메지온 신약의 침투율이 예상보다 높게 나올 거라는 지표들이 보였는데, 먼저 임상결과에 대한 의학계(소아심장과 의사들)의 긍정적인 반응, 미국 보건당국의 극찬과 OLE데이터의 운동능력향상에 대한 결과물, 마지막으로 FALD 임상의 결과가 좋을 것 같은 기대감 등이 있습니다.
이러한 요소들을 조합해 볼 때 침투율은 높을 것으로 예상됩니다. 참고로 3상임상모집때 약 1,400명을 SCREEN했고 그중 400명이 임상에 참여하였습니다. 이 중 300명이 OLE 실험에 계속 참여하고 있습니다. 임상 중엔 약을 물론 무상으로 제공받고 있는 상황이나 유데나필이 승인받는 시점부터는 각자 의료보험을 통해 메지온 신약을 구매해야 합니다. 이는 EAP 추진 이유 중 하나인 시장점유율 확보가 3상과 OLE를 통해 일부 달성됐다고 생각됩니다. 참고로 임상에 참여한 모든 환자들한테 인가시까지 약을 복용할 수 있도록 해주겠다는 약속도 충실히 이행하고 있습니다.
감사합니다